“科”技专栏 | 化学蛋白质组学技术,在细胞中直接鉴定非共价药物结合口袋
发布日期:2022-11-02 浏览次数:3490
小分子药物由来已久,在生物体中小分子与蛋白质之间的相互作用关系(例如靶点占据率,选择性等)是药物结构改良和成药的关键。目前绝大多数生物体内源性活性分子、小分子药物和天然产物与其靶标蛋白的结合是非共价的,通常以氢键、п-п堆积等作用力与靶点蛋白结合。
在小分子药物开发过程中,确定药物与靶点蛋白之间的结合方式至关重要,一方面有助于理解药物作用机制,另一方面为其后续结构优化提供数据支持。结构生物学技术,包括X-ray, cryo-EM, NMR等,已经被广泛应用于药物结合模型确定中,尤其是高分辨率的药物-蛋白共晶结构,能够极大的帮助药物结构优化。然而,一直以来,蛋白质结构解析都是生命科学研究中的挑战性任务,尤其是GPCR,离子通道等膜蛋白靶点。通常,为了得到蛋白质结构,需要进行蛋白质表达纯化,人工筛选药物和蛋白结晶条件,晶体数据采集和解析等过程,需要大量的时间和成本投入。
在细胞水平,确定药物和靶点蛋白质的直接作用方式,是药物开发者梦寐以求的事情,避免了蛋白质在纯化过程中结构的丢失以及人工筛选的缓冲体系和高浓度药物-蛋白条件带来的假阳性。
近年来,随着交叉学科技术在生物医药领域的应用与发展,化学蛋白质组学技术在药物靶点发现和结构模型鉴定中大放异彩。
如下图所示,其原理是利用具有生物活性的光亲和化学探针(与药物分子活性类似),在药物正常使用浓度下,与疾病相关细胞或组织孵育,原位快速光交联即可将药物分子探针与蛋白质靶点之间的非共价作用转化为共价作用,经过靶点蛋白质富集,酶切释放非修饰肽段,选择性富集药物分子探针修饰肽段,借助于高分辨生物大分子质谱,即可快速确定肽段信息。
由于化学探针仅能与空间临近的肽段,即结合口袋附近的肽段发生原位交联,因此,通过该肽段信息不仅能够确定靶点信息,同时能够获得药物结合口袋信息,再借助于分子对接,能够快速得到药物与靶点蛋白质的结合模型,供后续实验验证与使用。
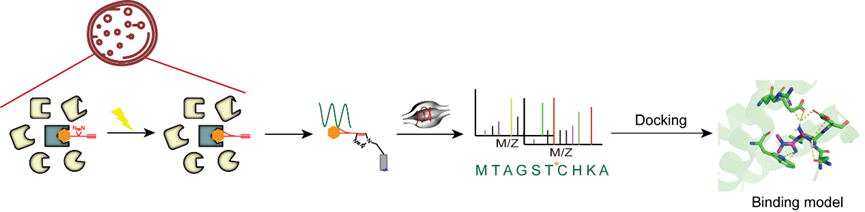
图1 活细胞中,非共价药物的结合口袋发现
近日,厦门大学林圣彩院士与邓贤明教授利用化学蛋白质组学技术揭示了二甲双胍的分子靶点,研究团队通过对二甲双胍结构改造,使其具有光交联位点。应用原位快速光交联策略和点击化学反应,利用质谱检测,鉴定出PEN2蛋白上与二甲双胍相关的关键活性位点F35和E40。(成果刊已发表:《Nature》(DOI: 10.1038/s41586-022-04431-8))
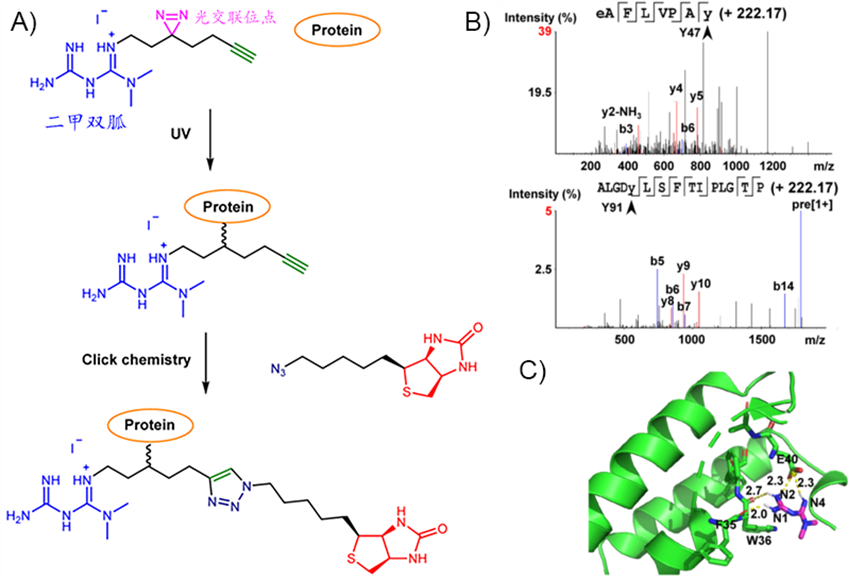
图2 二甲双胍类似物探针捕获及鉴定结合口袋过程
化学蛋白质组学技术加速了细胞内代谢物、天然产物、合成药物等小分子的靶点研究和全新药物先导化合物的发现,为小分子新药研发注入了新的活力,使得原来被认为“不可成药”的蛋白质有了成为新的治疗靶点的可能。不断发展的化学蛋白组学技术已经成为了新药研发的强大助力,提高了药物研发的成功率,将药物开发带入了高速发展的新纪元。
参考文献1. Chemoproteomics reveals baicalin activates hepatic CPT1 to ameliorate diet-induced obesity and hepatic steatosis. PNAS, 2018, 115, E5896-E5905.2. Low-dose metformin targets the lysosomal AMPK pathway through PEN2. Nature, 2022, 603, 159-165.